Состав атома.
Атом состоит из атомного ядра и электронной оболочки.
Ядро атома состоит из протонов (p+) и нейтронов (n0). У большинства атомов водорода ядро состоит из одного протона.
Число протонов N(p+) равно заряду ядра (Z) и порядковому номеру элемента в естественном ряду элементов (и в периодической системе элементов).
N(p+) = Z
Сумма числа нейтронов N(n0), обозначаемого просто буквой N, и числа протонов Z называется массовым числом и обозначается буквой А.
A = Z + N
Электронная оболочка атома состоит из движущихся вокруг ядра электронов (е-).
Число электронов N(e-) в электронной оболочке нейтрального атома равно числу протонов Z в его ядре.
Масса протона примерно равна массе нейтрона и в 1840 раз больше массы электрона, поэтому масса атома практически равна массе ядра.
Форма атома - сферическая. Радиус ядра примерно в 100000 раз меньше радиуса атома.
Химический элемент - вид атомов (совокупность атомов) с одинаковым зарядом ядра (с одинаковым числом протонов в ядре).
Изотоп - совокупность атомов одного элемента с одинаковым числом нейтронов в ядре (или вид атомов с одинаковым числом протонов и одинаковым числом нейтронов в ядре).
Разные изотопы отличаются друг от друга числом нейтронов в ядрах их атомов.
Обозначение отдельного атома или изотопа: (Э - символ элемента), например: ![]()
Строение электронной оболочки атома
Атомная орбиталь - состояние электрона в атоме. Условное обозначение орбитали - . Каждой орбитали соответствует электронное облако.
Орбитали реальных атомов в основном (невозбужденном) состоянии бывают четырех типов: s, p, d и f.
Электронное облако - часть пространства, в которой электрон можно обнаружить с вероятностью 90 (или более) процентов.
Примечание: иногда понятия "атомная орбиталь" и "электронное облако" не различают, называя и то, и другое "атомной орбиталью".
Электронная оболочка атома слоистая. Электронный слой образован электронными облаками одинакового размера. Орбитали одного слоя образуют электронный ("энергетический") уровень, их энергии одинаковы у атома водорода, но различаются у других атомов.
Порядок заполнения электронами орбиталей атома определяется тремя законами природы (формулировки даны упрощенно):
1. Принцип наименьшей энергии - электроны заполняют орбитали в порядке возрастания энергии орбиталей.
2. Принцип Паули - на одной орбитали не может быть больше двух электронов.
3. Правило Хунда - в пределах подуровня электроны сначала заполняют свободные орбитали (по одному), и лишь после этого образуют электронные пары.
Общее число электронов на электронном уровне (или в электронном слое) равно 2n2.
Распределение подуровней по энергиям выражается рядом (в прядке увеличения энергии):
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p ...
Наглядно эта последовательность выражается энергетической диаграммой: 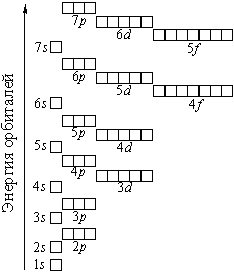
Валентные электроны - электроны атома, которые могут принимать участие в образовании химических связей. У любого атома это все внешние электроны плюс те предвнешние электроны, энергия которых больше, чем у внешних. Например: у атома Ca внешние электроны - 4s2, они же и валентные; у атома Fe внешние электроны - 4s2, но у него есть 3d6, следовательно у атома железа 8 валентных электронов. Валентная электронная формула атома кальция - 4s2, а атома железа - 4s23d6.
Периодическая система химических элементов Д. И. Менделеева
(естественная система химических элементов)
Периодический закон химических элементов (современная формулировка): свойства химических элементов, а также простых и сложных веществ, ими образуемых, находятся в периодической зависимости от значения заряда из атомных ядер.
Периодическая система - графическое выражение периодического закона.
Естественный ряд химических элементов - ряд химических элементов, выстроенных по возрастанию числа протонов в ядрах их атомов, или, что то же самое, по возрастанию зарядов ядер этих атомов. Порядковый номер элемента в этом ряду равен числу протонов в ядре любого атома этого элемента.
Таблица химических элементов строится путем "разрезания" естественного ряда химических элементов на периоды (горизонтальные строки таблицы) и объединения в группы (вертикальные столбцы таблицы) элементов, со сходным электронным строением атомов.
В зависимости от способа объединения элементов в группы таблица может быть длиннопериодной (в группы собраны элементы с одинаковым числом и типом валентных электронов) и короткопериодной (в группы собраны элементы с одинаковым числом валентных электронов).
Группы короткопериодной таблицы делятся на подгруппы (главные и побочные), совпадающие с группами длиннопериодной таблицы.
У всех атомов элементов одного периода одинаковое число электронных слоев, равное номеру периода.
Число элементов в периодах: 2, 8, 8, 18, 18, 32, 32. Большинство элементов восьмого периода получены искусственно, последние элементы этого периода еще не синтезированы. Все периоды, кроме первого начинаются с элемента, образующего щелочной металл (Li, Na, K и т. д.), а заканчиваются элементом, образующим благородный газ (He, Ne, Ar, Kr и т. д.).
В короткопериодной таблице - восемь групп, каждая из которых делится на две подгруппы (главную и побочную), в длиннопериодной таблице - шестнадцать групп, которые нумеруются римскими цифрами с буквами А или В, например: IA, IIIB, VIA, VIIB. Группа IA длиннопериодной таблицы соответствует главной подгруппе первой группы короткопериодной таблицы; группа VIIB - побочной подгруппе седьмой группы: остальные - аналогично.
Характеристики химических элементов закономерно изменяются в группах и периодах.
В периодах (с увеличением порядкового номера)
увеличивается заряд ядра,
увеличивается число внешних электронов,
уменьшается радиус атомов,
увеличивается прочность связи электронов с ядром (энергия ионизации),
увеличивается электроотрицательность,
усиливаются окислительные свойства простых веществ ("неметалличность"),
ослабевают восстановительные свойства простых веществ ("металличность"),
ослабевает основный характер гидроксидов и соответствующих оксидов,
возрастает кислотный характер гидроксидов и соответствующих оксидов.
В группах (с увеличением порядкового номера)
увеличивается заряд ядра,
увеличивается радиус атомов (только в А-группах),
уменьшается прочность связи электронов с ядром (энергия ионизации; только в А-группах),
уменьшается электроотрицательность (только в А-группах),
ослабевают окислительные свойства простых веществ ("неметалличность"; только в А-группах),
усиливаются восстановительные свойства простых веществ ("металличность"; только в А-группах),
возрастает основный характер гидроксидов и соответствующих оксидов (только в А-группах),
ослабевает кислотный характер гидроксидов и соответствующих оксидов (только в А-группах),
снижается устойчивость водородных соединений (повышается их восстановительная активность; только в А-группах).
Какую работу совершает сила тяжести, действующая
на дождевую каплю массой 20 мг, при ее падении с высоты
2 км?
Составьте уравнения реакций в соответствии со схемой превра-
щений:
N2 → NH3 → NO → NO2 → HNO3 → AgNO3 (Подробнее...)
Как решить функцию?
Задает ли указанное правило функцию у = f(x):
(Подробнее...)
Товарищи хелп, горит контрольная, как ответить? (Подробнее...)
Как исследовать функцию на четность? (Подробнее...)















