Лабораторные опыты 18 и 19 Химия 9 класс Рудзитис, Фельдман
Кто сделал лабы?
Получение гидроксида железа(II) и взаимодействие его с кислотами.
1. Налейте в пробирку 2—3 мл свежеприготовленного раствора сульфата железа(II) и добавьте немного раствора гидроксида натрия. 2. К полученному осадку добавьте немного соляной кислоты.
Получение гидроксида железа(III) и взаимодействие его с кислотами.
1. Налейте в пробирку 2—3 мл раствора хлорида железа(III) и добавьте немного раствора гидроксида натрия. 2. К полученному осадку добавьте немного серной кислоты.
Задания.
1. Как получают гидроксид железа(II) и гидроксид железа(III)?
2. Какого цвета полученные осадки? 3. Какие вещества образуются при взаимодействии полученных осадков с кислотами? 4. Напишите уравнения соответствующих реакций в молекулярном, ионном и сокращенном ионном виде. 5. Как можно определить ионы железа Fе2+ и Fе3+?
Получение гидроксида железа(II) и взаимодействие его с кислотами.
Получение гидроксида железа(III) и взаимодействие его с кислотами.
1. Гидроксид железа (II) получают действием
щелочей на водные растворы солей железа (II):
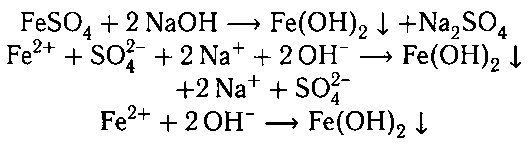
Гидроксид железа (III) получают взаимодействи-
ем солей железа (III) со щелочами:
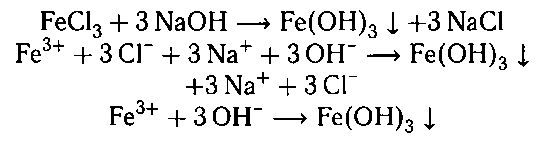
Также можно получить взаимодействием чисто-
го железа при нагревании с водой в присутствии
кислорода воздуха:
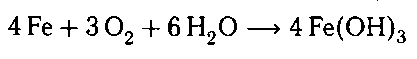
3. Гидроксид железа (II) зеленого цвета, гид-
роксид железа (III) бурого цвета.
4. При взаимодействии полученных осадков с
кислотами получаются соли железа:
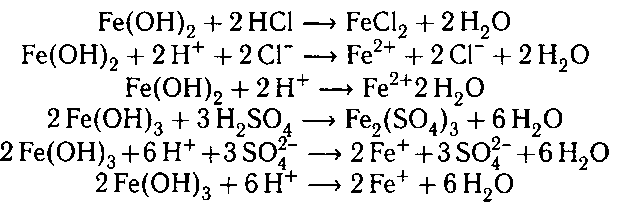
5. Ионы Fe2+ от Fe3+ можно отличить по цвету их
гидроксидов: зеленого Fe(OH)2, бурого — Fe(OH)3.
Подскажите верное решение) вот условие: Какой объем воздуха (н. у.) потребуется для сжигания 1 м3 бутана-1?
Среди предложений 21-29:
(21) И Митрофанов услышал в этом смехе и прощение себе, и даже какое-то (Подробнее...)















