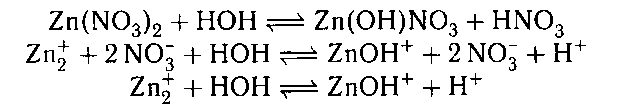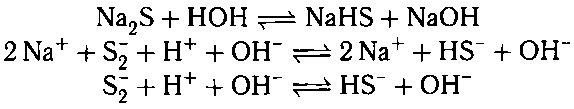Гидролиз солей — это химическое взаимодей-
ствие ионов соли с ионами воды, приводящее к
образованию слабого электролита. Гидролизу под-
вергаются соли, образованные слабым основанием
и сильной кислотой, сильным основанием и слабой
кислотой. Соль, образованная слабым основанием
и слабой кислотой гидролизуется и по катиону, и
по аниону. В результате образуется малодиссоции-
рующие основание и кислота. pH растворов таких
солей зависит от относительной силы кислоты и ос-
нования. Реакция среды этих растворов может быть
нейтральной, слабокислой или слабощелочной. Это
объясняется тем, что в составе таких солей имеются
ионы, которые могут связываться с ионами Н+ или
ОН−. Соль, образованная сильным основанием и
сильной кислотой гидролизу подвергаться не будет,
так как в этом случае слабый электролит не обра-
зуется. В соли, образованной слабым основанием и
сильной кислотой гидролизу подвергается катион:
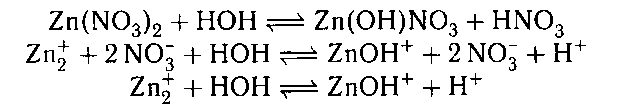
В результате образуется слабый электролит, ион
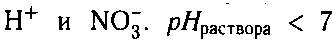
(раствор приобретает кислую реакцию).
Соль, образованная сильным основанием и сла-
бой кислотой подвергается гидролизу по аниону:
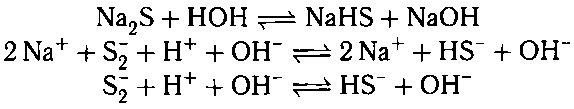
В результате образуется слабый электролит и
гидроксид ион. рHраствора > 7, то есть раствор
приобретает щелочную реакцию.
Сульфат калия (K2SО4) гидролизу подвергать-
ся не будет, так как соль образована сильным
основанием и сильной кислотой.