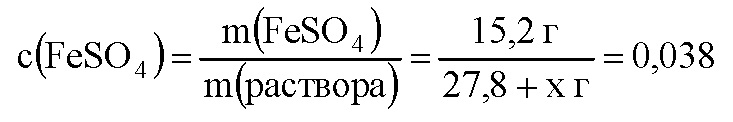Вычислим молярные массы сульфата железа и его кристаллогидрата:
M(FeSO4) = 56 + 32 + 164 = 152 г/моль.
М(FеSО4 • 7H2O) = M(FeSО4) + 7 • M(H2O) = 152 + 7 • (1 • 2 + 16) = 278 г/моль.
Вычислим количество вещества кристаллогидрата:
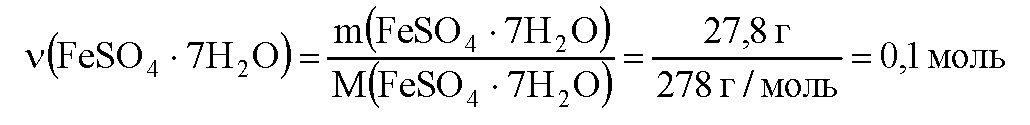
В 1 моль кристаллогидрата содержится 1 моль сульфата железа, значит в 0,1 моль кристаллогидрата содержится 0,1 моль сульфата железа. Вычислим массу сульфата железа:
m(FeSО4) = v(FeSО4) • M(FeSО4) = 0,1 моль • 152 г/моль = 15,2 г.
Пусть для получения раствора с массовой долей 3,8%, или 0,038, нужно прибавить к кристаллогидрату сульфата железа х г воды. Масса раствора будет равна 27,8 + х г, а масса растворенного вещества (сульфата железа) –15,2 г. Составим уравнение:
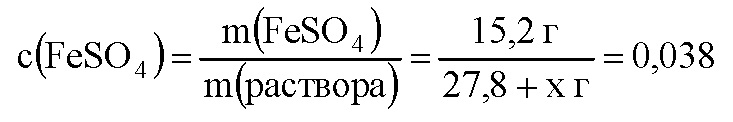
Отсюда
0,038 • (27,8 + х) = 15,2, 1,0564 + 0,038х = 15,2
0,038х = 14,1436
х = 372,2
Ответ: нужно растворить кристаллогидрат в 372,2 мл воды.