Самые занудные задания учебника - этого типа)
Хлор Сl2
Общая характеристика. Элемент главной подгруппы VII группы периодической системы Менделеева. Галоген, типичный неметалл.
Нахождение в природе. В природе хлор обычно встречается в виде хлоридов: NaCl, КСl, MgCl2. Они содержатся, в основном, в морской
воде.
Получение.
а) в лаборатории. Действием на соляную кислоту сильными окислителями:
MnO2 + 4НСl → МnСl2 + Сl2 + 2 Н2O.
б) в промышленности. Электролизом растворов хлоридов натрия или калия. При этом происходит окисление хлора:
Сl-1-2е→Cl02
Физические свойства. При нормальных условиях хлор — газ желто-зеленого цвета с удушающим запахом. Газообразный хлор относительно легко сжижается. Температура кипения -34 ° С. Температура плавления -100° С. Ограниченно растворяется в воде.
Химические свойства.
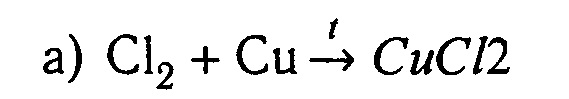
Cl2 + 2 Na → 2 NaCl
6) F2 + Cl2 → 2ClF
Cl2 + H2 →2 HCl
3 Cl2 + 2 Р(красн) → 2 PCl3
b) Cl2 + H2O → HCl + HClO
г) 3 Cl2 + 6 NaOH → NaClO3 + 5 NaCl + 3 H2O
2 Cl2 + 2 Ba(OH)2 → Ba(ClO)2 + BaCl2 + 2 H2O
д) Cl2 + 2 NaBr → 2 NaCl + Br2
Cl2 + 2 NaI → 2 NaCl + I2
Применение. В производстве поливинилхлорида, пластикатов, синтетического каучука. В качестве отбеливателя тканей, бумаги, картона. Производство хлорорганических инсектицидов. Для производства боевых отравляющих веществ. Для обеззараживания воды. В пищевой промышленности в качестве пищевой добавки. В химическом производстве хлоридов металлов, ядов, лекарств, удобрений.
Соляная кислота HCl
Общая характеристика. Сильная одноосновная кислота.
Нахождение в природе. Входит в состав желудочного сока. На одном из Курильских островов есть озеро, заполненное концентрированным раствором серной и соляной кислот.
Получение.
а) в лаборатории
Н2 + Сl2→2НСl
H2SO4(кoнц) + 2 NaCl → Na2SO4 + 2 НСl↓
(этим способом соляную кислоту получают
и в промышленности)
б) в промышленности
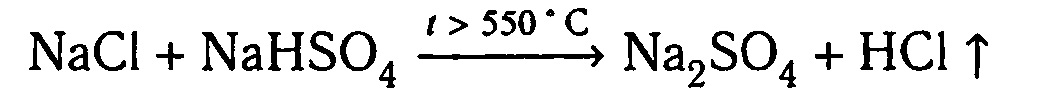
Физические свойства. Бесцветная, «дымящая» на воздухе, едкая жидкость. Плотность раствора 1,19 г/см3. Молярная масса 36,46 г/моль При затвердевании даёт кристаллогидраты составов НСl · Н2O, НСl · 2 Н2O, НСl · 3Н2O, НСl · 6Н2O. Хлороводород растворим в воде. При попадании на кожу вызывает ожоги.
Химические свойства.
2Na + 2HCl→ 2NaCl + H2
Al2O3 + 6 HCl → 2 AlCl3 + 3 H2O
Mg(OH)2 + 2 HCl → MgCl2 + 2 H2O
Na2CO3 + 2 HCl → 2 NaCl + H2O + CO2
2 KMnO4 + 16 HCl → 5 Cl2 + 2 MnCl2 + 2 KCl + 8H2O
NH3 + HCl → NH4Cl
Применение. В промышленности для очистки поверхности металлов, для получения хлоридов, в пищевой промышленности в качестве БАД, в медицине для нормализации кислотности желудочного сока.