1) Разбавленная серная кислота выступает в качестве электролита в
ионных реакциях. Например,
ВаCl2 + H2SO4 => BaSO4 + 2НСl; Ва2+ + SO42- => BaSO4↓.
Серная кислота проявляет свойства окислителя. В ОВР H2SO4 всту-
пает только концентрированная.
2) Рассмотрим реакции H2SO4 с металлами Zn и Сu с позиции окис-
лительно-восстановительных реакций. Zn + H2SO4(разб.) => ZnSO4 + H2↑,
Сu + 2H2SO4(конц ) => CuSO4 + SO2↑ + 2H2O.
И в том и в другом случае идет ОВР, но в первой реакции роль
окислителя играют катионы Н+, а во второй — сера.
Запишем ионное уравнение для первой реакции.
Zn° + 2Н+ => Zn2+ + Н2 ↑.
Эту реакцию можно отнести к реакциям ионного обмена.
3) Теперь рассмотрим реакции ионного обмена с позиции теории
электролитической диссоциации. Как вы знаете, реакция ионного обме-
на идет только в том случае, если в результате образуется слабо диссо-
циирующее вещество. Например, ZnSO4 + MgCl2 ←→ MgSO4 + ZnCl2.
Реакция не идет, т.к. не образуются малодиссоциирующие вещества.
В растворе находится смесь ионов.
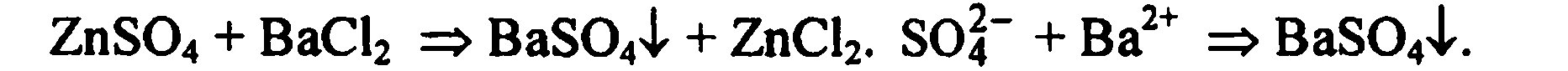
Реакция протекает, т.к. BaSO4 — малорастворим















