Практическая работа 4 Химия 9 класс Рудзитис, Фельдман Определение минеральных удобрений.
Определение минеральных удобрений.
В пробирках даны образцы следующих минеральных удобрений: 1) суперфосфат, нитрат аммония, сульфат аммония; 2) хлорид аммония, нитрат натрия, хлорид калия. Определите, в какой пробирке находится каждое из указанных удобрений, используя таблицу 20. Составьте уравнения происходящих химических реакций. (Для реакций, происходящих в водном растворе, уравнения составьте в ионном и сокращенном ионном виде.)
Решение экспериментальных задач. 1. Получите аммиак и проделайте с ним характерные химические реакции.
2. Получите нитрат меди(И) двумя различными способами.
3. Опытным путем докажите, что сульфат аммония, нитрат аммония, хлорид аммония и аммофосы нельзя смешивать с известью. Приведите соответствующие объяснения.
4. В четырех пробирках находятся следующие кристаллические вещества: сульфат натрия, хлорид аммония и нитрат натрия. Определите, в каких пробирках находится каждое из этих веществ.
5. В одной пробирке дан раствор ортофосфорной кислоты, а в другой — раствор серной кислоты. Определите каждую из этих кислот.
6. В одной пробирке дан ортофосфат натрия, а в другой — ортофосфат кальция. Определите эти соли.
Определение минеральных удобрений.
1) К содержимому пробирок добавляем воду. В
пробирке с суперфосфатом вещество растворилось
не полностью. Затем к этому раствору добавля-
ем раствор нитрата серебра. Выделяется желтый
осадок.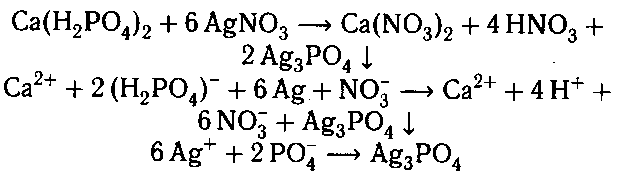
К оставшимся растворам добавляем раствор хло-
рида бария. В пробирке с сульфатом аммония вы-
падает белый осадок.
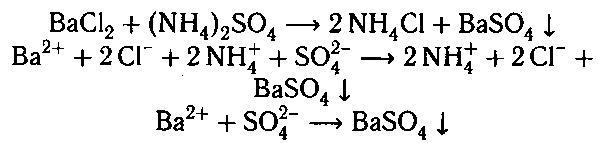
В оставшиеся пробирки добавляем концентри-
рованную серную кислоту и медь при нагревании.
Выделяется газ бурого цвета; раствор приобретает
голубую окраску; медь растворяется.
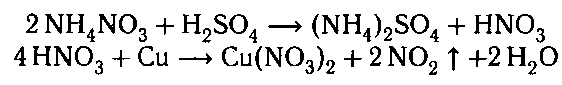
В данной пробирке находится нитрат аммония,
так как данная реакция является качественной на
нитрат-ион.
2) К веществам добавляем раствор щелочи, на-
греваем. В пробирке с хлоридом аммония образуется
газ с резким запахом — аммиак.
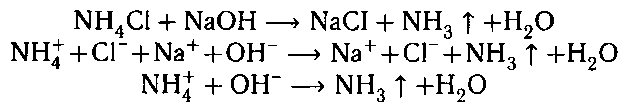
К двум оставшимся веществам добавляем рас-
твор нитрата серебра. В пробирке с хлоридом калия
выпадает белый осадок.
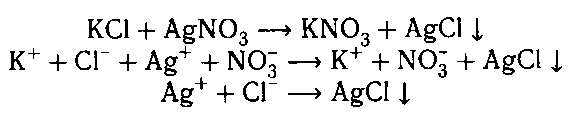
К оставшемуся веществу добавляем концентри-
рованную серную кислоту и медь при нагревании.
Выделяется газ бурого цвета (NO2); раствор ста-
новится голубого цвета; медь растворяется.
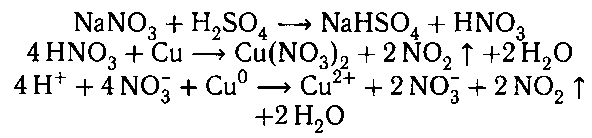
Решение экспериментальных задач.
1.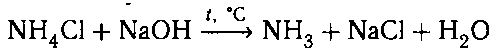
Взаимодействие с водой: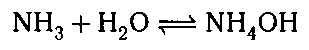
Взаимодействие с азотной кислотой:![]()
Взаимодействие с щелочными металлами: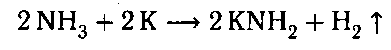
2. 1) азотная кислота с оксидом меди (II)![]()
2) медь с азотной кислотой:![]()
1. При смешивании сульфата, нитрата, хлори-
да аммония, аммофосов с известью выделяется
аммиак:
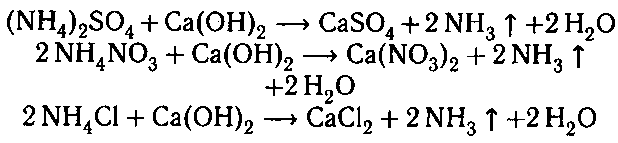
В результате этого азот, который необходим для
растений, не будет поступать в почву.
2. К исследуемым веществам добавляем раствор
щелочи и нагреваем. В пробирке с хлоридом аммо-
ния выделяется аммиак — газ с резким запахом.![]()
В оставшиеся пробирки добавляем раствор хло-
рида бария. В пробирке с сульфатом натрия обра-
зуется белый осадок:![]()
К оставшемуся веществу добавляем концентри-
рованную серную кислоту и кусочек меди при
нагревании. Выделяется газ бурого цвета; рас-
твор становится голубого цвета; медь растворяется.
В этой пробирке находится нитрат натрия.
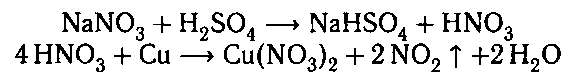
3. К обоим растворам добавляем нитрат се-
ребра. В одной пробирке наблюдается помутнение
раствора, а в другой образуется желтый осадок.
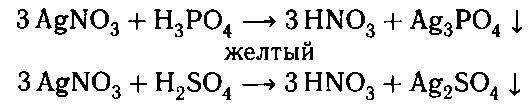
Осадок Ag2SО4 растворим в кислотах, поэтому
раствор мутнеет.
4. Добавляем в обе пробирки воду. В пробирке
с ортофосфатом натрия вещество растворится. Во
второй пробирке вещество не растворится, следова-
тельно, в ней находится ортофосфат кальция, так
как он не растворим в воде.
Подскажите верное решение) вот условие: Какой объем воздуха (н. у.) потребуется для сжигания 1 м3 бутана-1?
Среди предложений 21-29:
(21) И Митрофанов услышал в этом смехе и прощение себе, и даже какое-то (Подробнее...)
18.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее...)















