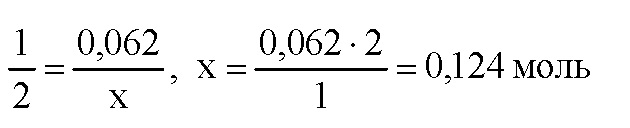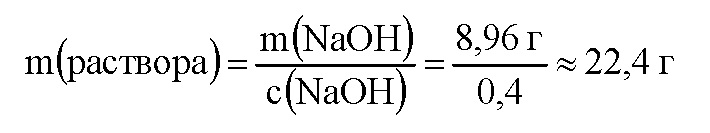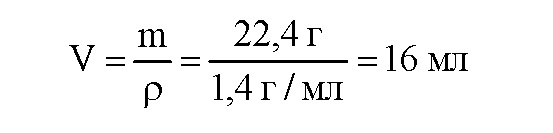У меня есть, вот это посмотри
Уравнения реакций:
2Аl + 2NaOH + 6Н2О = 2Na[Al(OH)4] + 3Н2 (1)
Аl2О3 + 2NaOH + 3Н2О = 2Na[Al(OH)4] (2)
Вычислим количество вещества выделившегося водорода:
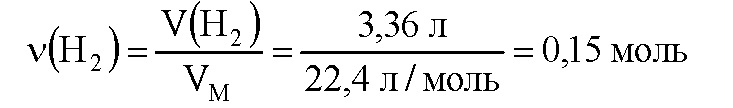
По уравнению реакции при взаимодействии 2 моль алюминия с раствором щелочи выделяется 3 моль водорода. Пусть 0,15 моль водорода выделится при реакции x моль алюминия с раствором щелочи. Составим пропорцию:
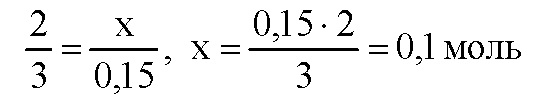
Молярная масса алюминия равна 27 г/моль, вычислим массу
алюминия:
m(Al) = v(Al) • M(Al) = 0,1 моль • 27 г/моль = 2,7 г Вычислим массовую долю алюминия в смеси:
Вычислим массовую долю оксида алюминия в смеси:
w(Аl2О3) = 100% – w(A1) = 70%.
По уравнению (1) 2 моль алюминия реагирует с 2 моль гидроксида натрия, значит 0,1 моль алюминия реагирует с 0,1 моль гидроксида натрия. В смеси содержится 9 – 2,7 = 6,3 г оксида алюминия. Вычислим молярную массу оксида алюминия:
M(Al2O3) = 27 • 2 + 16 • 3 = 102 г/моль.
Вычислим количество вещества оксида алюминия:
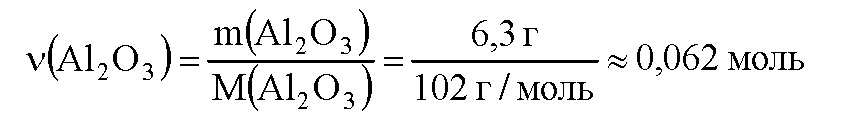
По уравнению реакции (2) 1 моль оксида алюминия реагирует с 2 моль гидроксида алюминия. Пусть 0,062 моль оксида алюминия реагирует с х моль гидроксида натрия. Составим пропорцию:
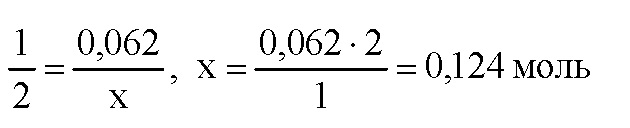
Таким образом, всего необходимо 0,1 + 0,124 = 0,224 моль гидроксида натрия. Определим молярную массу гидроксида натрия: M(NaOH) = 23 + 16 + 1 = 40 г/моль Вычислим массу гидроксида натрия:
m(NaOH) = v(NaOH) • M(NaOH) = 0,224 моль • 40 г/моль = 8,96 г.
Вычислим массу раствора гидроксида натрия с концентрацией 40%, или 0,4.
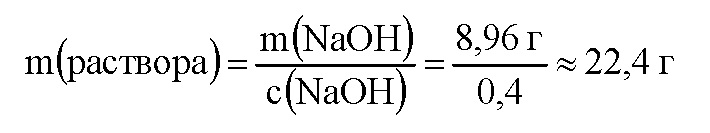
Вычислим объем раствора: гидроксида натрия:
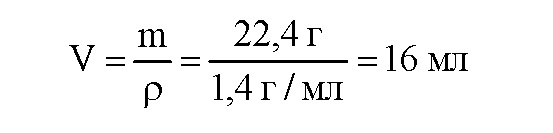
Ответ: в смеси содержится 30% алюминия и 70% оксида алюминия; потребуется 16 мл раствора гидроксида натрия.