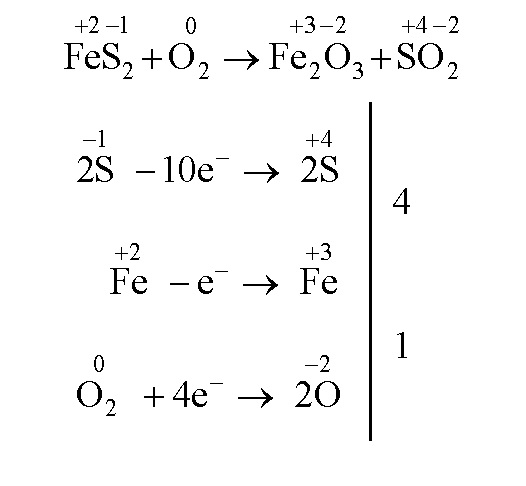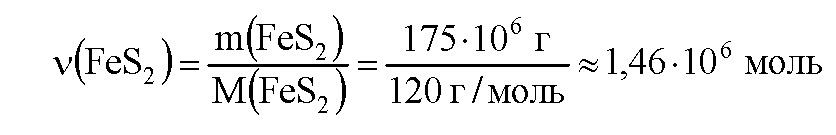Из пирита сначала получают оксид железа (III):
FeS2 + О2 → Fе2О3 + SO2
Для расстановки коэффициентов воспользуемся методом электронного баланса:
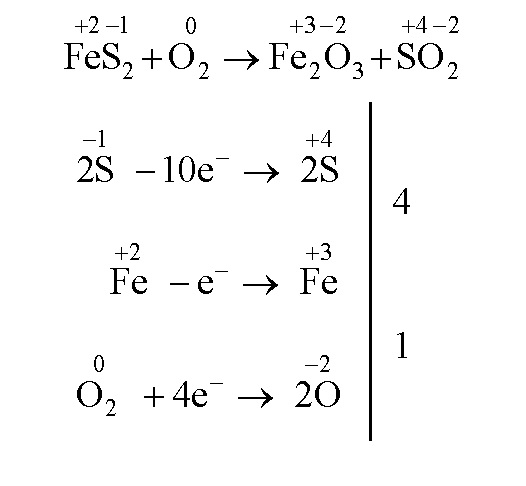
4FeS2 + 11O2 = 2Fе2О3 + 8SO2
Из оксида железа (III) железо можно получить при помощи любого подходящего восстановителя, например оксида углерода (II):
Fе2О3 + 3СО = 2Fe + 3СО2(2)
Вычислим массу чистого пирита в руде:
M(FeS2) = w(FеS2) • m(руды) = 0,7 • 250 т = 175 т.
Вычислим молярную массу пирита:
M(FeS2) = 56 + 32 • 2 = 120 г/моль Вычислим количество вещества пирита:
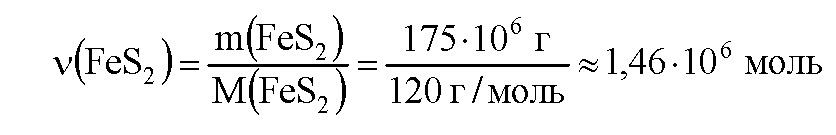
По уравнению (1) из 4 моль пирита получится 2 моль оксида железа. По уравнению (2) из 1 моль оксида железа получается 2 моль железа. Всего, значит, из 4 моль пирита получается 4 моль железа. Следовательно, из 1,46·106 моль пирита при теоретическом 100% выходе можно получить 1,46·106 моль железа. Поскольку выход железа составляет 82%, или 0,82, практически можно получить 0,82 · 1,46·106 и 1,2·106 моль. Молярная масса железа равна 56 г/моль, вычислим массу железа:
m(Fe) = v(Fe) • M(Fe) = 1,2·106 моль • 56 г/моль = 67,2 • 106 = 67,2 т.
Ответ: можно получить 67,2 т железа.