ВОт мое
В осадок выпадает сульфид меди (II):
CuSO4 + H2S = CuS↓- + H2SO4 Вычислим количество вещества сероводорода:
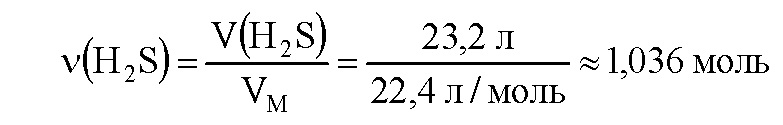
Вычислим массу раствора сульфата меди:
m(раствора) = ρ • V = 1,12 г/мл • 1000 мл = 1120 г. Вычислим массу сульфата меди в растворе:
m(CuSO4) = c(CuSO4) • m(раствора) = 0,18 • 1120 г = 201,6 г Определим молярную массу сульфата меди:
M(CuSO4) = 64 + 32 + 16 • 4 = 160 г/моль Вычислим количество вещества сульфата меди:
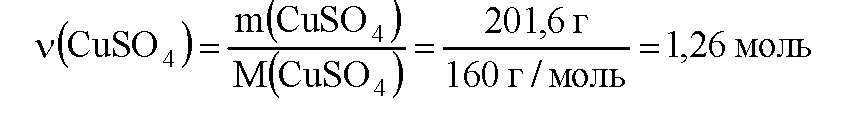
По уравнению реакции 1 моль сероводорода реагирует с 1 моль сульфата меди, значит в реакцию с 1,036 моль сероводорода вступит 1,036 моль сульфата меди, то есть сульфат меди взят в избытке и расчет ведем по сероводороду. По уравнению реакции из 1 моль сероводорода образуется 1 моль сульфида меди (II), значит из 1,036 моль сероводорода образуется 1,036 моль сульфида меди (II). Вычислим молярную массу сульфида меди (II):
M(CuS) = 64 + 32 = 96 г/моль.
Вычислим массу сульфида меди (II):
m(CuS) = v(CuS) • M(CuS) = 1,036 моль • 96 г/моль ≈120,96 г.
В осадок выпадает 121 г сульфида меди (II).















