Тип химической связи. Химия. 8 класс. Габриелян. ГДЗ. § 12. Глава 1. Вопрос 2.
Помогите. Определите тип химической связи и запишите схему её образования для веществ с формулами:
а) S2, К2O и Н2S; б) N2, Li3N и С13N.
Лови ответ.
1. а) в молекуле S2связь ковалентная неполярная, т.к. она образована атомами одного и того же элемента. Схема образования связи будет следующей:
Сера— элемент главной подгруппы VI группы. Ее атомы имеют по
6 электронов на внешней оболочке. Непарных электронов будет:
8-6 = 2.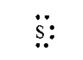
Обозначим внешние электроны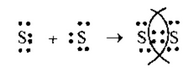
или
S = S
б) в молекуле К2О связь ионная, т.к. она образована атомами эле-
ментов металла и неметалла.
Калий — элемент I группы главной подгруппы, металл. Его атому
легче отдать 1 электрон, чем принять недостающие 7: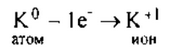
Кислород— элемент главной подгруппы VI группы, неметалл. Его
атому легче принять 2 электрона, которых не хватает до завершения уровня, чем отдать 6 электронов: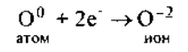
Найдем наименьшее общее кратное между зарядами образовавших-
ся ионов, оно равно 2(2∙1). Чтобы атомы калия отдали 2 электрона, их нужно взять 2, чтобы атомы кислорода смогли принять 2 электрона, необходим только 1 атом:
в) в молекуле H2Sсвязь ковалентная полярная, т.к. она образована
атомами элементов с различной ЭО. Схема образования связи будет следующей:
Сера— элемент главной подгруппы VI группы. Ее атомы имеют
по 6 электронов на внешней оболочке. Непарных электронов будет: 8-6=2.
Водород— элемент главной подгруппы 1 группы. Его атомы содер-
жат по 1 электрону на внешней оболочке. Непарным является 1 электрон (для атома водорода завершенным является двухэлектронный уровень).
Обозначим внешние электроны: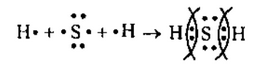
или![]()
Общие электронные пары смещены к атому серы, как более элек-
троотрицательному![]()
1. а) в молекуле N2связь ковалентная неполярная, т.к. она образована атомами одного и того же элемента. Схема образования связи следующая:
Азот— элемент главной подгруппы V группы. Его атомы имеют
5 электронов на внешней оболочке. Непарных электронов: 8-5 = 3.
Обозначим внешние электроны:![]()
или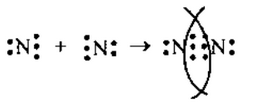
или![]()
б) в молекуле Li3N связь ионная, т.к. она образована атомами эле-
ментов металла и неметалла.
Литий — элемент главной подгруппы I группы, металл. Его атому
легче отдать 1 электрон, чем принять недостающие 7: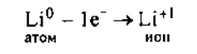
Азот— элемент главной подгруппы V группы, неметалл. Его атому
легче принять 3 электрона, которых не хватает до завершения внешнего уровня, чем отдать пять электронов с внешнего уровня:![]()
Найдем наименьшее общее кратное между зарядами образовавших-
ся ионов, оно равно 3(3• 1). Чтобы атомы лития отдали 3 электрона, необходимо 3 атома, чтобы атомы азота смогли принять 3 электрона, необходим только один атом: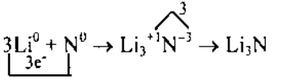
в) в молекуле NCI3связь ковалентная полярная, т.к. она образована
атомами элементов-неметаллов с различными значениями ЭО. Схема образования связи следующая:
Азот— элемент главной подгруппы V группы. Его атомы имеют
по 5 электронов на внешней оболочке. Непарных электронов будет: 8-5=3.
Хлор— элемент главной подгруппы VII группы. Его атомы содер-
жат по 7 электронов на внешней оболочке. Непарным остается 1 электрон.
Обозначим внешние электроны: ![]()

Общие электронные пары смещены к атому азота, как более элек-
троотрицательному: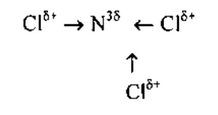
Попробуйте провести следующий опыт. Влияние воздуха на горение свечи.
Вставьте стеклянную трубку с оттянутым концом в резиновую (Подробнее...)
Попробуйте провести следующий опыт. Приготовление раствора
сахара и расчёт его массовой доли в растворе.
Отмерьте мерным (Подробнее...)
Хочется узнать, когда собираются сократить иностранные языки в школе? Какой в итоге оставят? (Подробнее...)
11.
Выпишите слово, в котором на месте пропуска пишется буква Е.
произнос., шь (Подробнее...)















